I. Giới thiệu
Viêm gan B mạn tính vẫn còn là một vấn đề y tế quan trọng toàn cầu. Sự tiến triển đến xơ gan, bệnh gan mất bù và ung thư biểu mô tế bào gan là những hậu quả bất lợi chính của bệnh chưa được điều trị. Vì vậy, mục tiêu trị liệu là để dự phòng các biến chứng này nhằm ngăn ngừa kết cuộc tử vong sớm do viêm gan B mạn tính. Hiện nay có 7 thuốc đã được chấp thuận để điều trị viêm gan B mạn tính ở Mỹ là: interferon alfa-2b, peginterferon alfa-2a, lamivudine, adefovir, entecavir , telbivudine, tenofovir .Các chất tương tự nucleos(t)ide kiểm soát sự sao chép của virus rất tốt, với các nồng độ có thể thay đổi được và độ bền lâu dài. Tuy nhiên, sự sao chép virus điển hình trở về lại các nồng độ có thể phát hiện được sau khi ngừng trị liệu bằng nuleos(t)ide, ngay cả ở những bệnh nhân ban đầu có kháng nguyên e viêm gan B (HBeAg) dương tính, nhưng bị mất HBeAg và phát triển kháng thể kháng HBeAg - sự chuyển đổi huyết thanh HBeAg - hoặc những người mất kháng nguyên bề mặt viêm gan B (HBsAg) trong thời gian điều trị. Vì vậy, mặc dù những thuốc này có thể kiểm soát nhiễm virus viêm gan B mạn tính nhưng hiếm khi chúng - nếu có, chữa khỏi bệnh. Sự giải thích có thể là có một dạng virus được gọi là “DNA vòng đóng đồng hóa trị (cccDNA)” đóng vai trò then chốt về sự tồn tại kéo dài của virus và sự tái hoạt động của virus sau khi ngừng điều trị. Tài liệu này nêu bật vai trò then chốt của cccDNA trong tiến trình nhiễm virus viêm gan B (HBV) tự nhiên và được điều trị.
II.cccDNA là gì?
cccDNA của virus viêm gan B tạo thành một dạng genome DNA của virus ổn định. cccDNA nằm ở nhân tế bào gan bị nhiễm dưới dạng nhiễm sắc thể nhỏ hoặc episome không tích hợp, ở đó nó hoạt động như một khuôn mẫu để phiên mã các gen của virus. Số bản sao (copies) của cccDNA có trong bất kỳ tế bào gan bị nhiễm nào đều biến thiên mạnh nhưng thường trong khoảng từ 10-50 bản sao mỗi tế bào gan.
1. cccDNA được sản xuất và duy trì như thế nào?
cccDNA được sản xuất trong quá trình sao chép của virus. Mặc dù virus viêm gan B (HBV) là một virus DNA chuỗi kép không hoàn chỉnh, nó sao chép qua trung gian RNA bằng cách sử dụng một polymerase của virus có hoạt tính transcriptase ngược. Sự sao chép của HBV xảy ra chủ yếu ở các tế bào gan. Khi đi vào tế bào, virus lột lớp vỏ protein của nó, và genome của chuỗi kép lỏng lẻo, không hoàn chỉnh được vận chuyển vào nhân. Ở nhân, các polymerase của vật chủ và virus sửa chữa genome vòng lỏng lẻo, không hoàn chỉnh thành một genome vòng đóng đồng hóa trị, có chuỗi kép hoàn chỉnh, hoặc cccDNA (Hình1). cccDNA hoạt động như một khuôn mẫu cho sự phiên mã của tất cả RNA thông tin (mRNA) của virus. mRNA của virus gồm 1) RNA pregenome, hoạt động như một khuôn mẫu cho sự phiên mã ngược, tổng hợp protein lõi và enzyme polymerase; 2) 3RNA subgenome cần cho sự dịch mã các protein của lớp vỏ ngoài; và 3) protein X, chức năng của protein này chưa được hiểu rõ. Một khi được tổng hợp, RNA của virus được vận chuyển đến bào tương là nơi dịch mã các protein của virus, lắp ráp nucleocapsid, và sự sao chép virus xảy ra.
Sự sao chép xảy ra trong nucleocapsid của virus gồm có protein lõi, RNA pregenome và polymerase. Sự hình thành nucleocapsid cần sự gắn kết phối hợp của polymerase với một cấu trúc RNA vòng thân gọi là epsilon ở vị trí đầu 5’ của RNA pregenome - một quá trình tạo ra sự capsid hóa do các hạt trong lõi. Polymerase gắn kết epsilon hoạt động như một protein mồi để tổng hợp DNA, với epsilon hoạt động như một khuôn mẫu cho phản ứng này. Sau khi sợi không mã hóa của DNA được tổng hợp hoàn toàn, RNA được làm thoái biến bởi RNase H của virus là một phần của polymerase. Tiếp theo là sự tổng hợp sợi mã hóa và tạo vòng genome của virus. Một khi sự sao chép hoàn tất, nucleocapsid của virus tương tác với protein của lớp vỏ ngoài ở lưới nội bào tương để tạo thành các virion trưởng thành được tiết ra từ tế bào. Các nucleocapsid của virus cũng có thể vận chuyển ngược trở lại nhân, đại diện cho một con đường rất quan trọng để duy trì cccDNA trong tế bào gan. Con đường này được cho là được điều hòa bởi protein lớn ở bề mặt.
Hình 1. Vòng đời của virus viêm gan B (HBV)
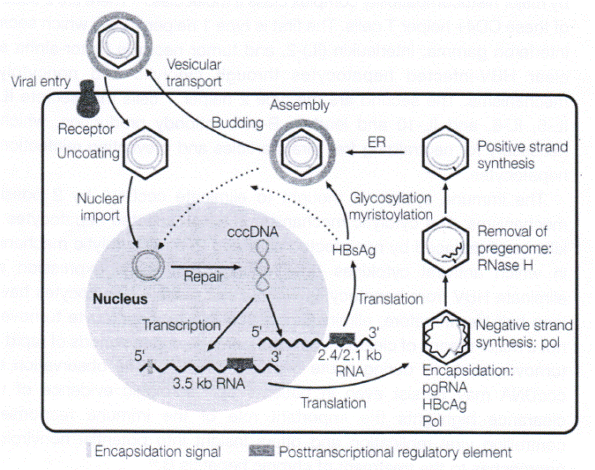
ER: lưới nội bào tương; HbcAg: kháng nguyên lõi viêm gan B; pgRNA: RNA pregenome;
Pol: polymerase
2. cccDNA được đào thải như thế nào?
Đáp ứng miễn dịch đóng vai trò cơ bản trong sự thanh thải virus cũng như làm trung gian của bệnh. Vì vậy, có lợi khi xem xét đáp ứng miễn dịch đối với nhiễm virus viêm gan B (HBV) để hiểu sự sao chép của virus được kiểm soát như thế nào.
Việc kiểm soát thành công HBV tùy thuộc vào tác động lẫn nhau phức tạp giữa các đáp ứng bẩm sinh, tế bào và thể dịch đối với sự nhiễm virus (Hình 2). Tuy nhiên, vai trò chính xác của đáp ứng bẩm sinh trong trường hợp nhiễm HBV cấp tính chưa rõ. Đáp ứng miễn dịch bẩm sinh không đặc hiệu bao gồm sự sản xuất interferon, hoạt hóa tế bào diệt tự nhiên, và hoạt hóa tế bào Kupffer, tất cả điều này có thể giúp kiểm soát sự sao chép của virus và hạn chế sự lan rộng của virus trong các giai đoạn sớm của nhiễm virus. Vai trò của đáp ứng tế bào và thể dịch đã được xác định tốt hơn. Đáp ứng của tế bào T trong nhiễm HBV cấp tính, tự giới hạn, được đặc trưng bởi một đáp ứng mạnh, đa clon, độc tế bào đa đặc hiệu và tế bào T hỗ trợ. Ngược lại, đáp ứng miễn dịch ở người mang virus mạn tính không rõ hoặc không phát hiện được. Tế bào lympho T hỗ trợ CD4+ nhận biết các kháng nguyên virus đã được xử lý, được trình diện bởi các phân tử phức hợp tương hợp mô chính nhóm II. Có 2 nhóm phụ của tế bào T hỗ trợ CD4+ này. Đầu tiên là tế bào T hỗ trợ type 1 tiết interferon gamma, interleukin (IL)-2, yếu tố hoại tử khối u alpha và làm sạch tế bào gan bị nhiễm HBV qua các cơ chế tiêu tế bào và không tiêu tế bào. Thứ hai là các tế bào T hỗ trợ type II tiết IL-4, IL-5, IL-6, IL-10 và dẫn đến sản xuất kháng thể của tế bào B cần để trung hòa các hạt virus tự do và phòng ngừa sự tái nhiễm của tế bào gan.
Hệ thống miễn dịch được cho là đào thải cccDNA do 2 cơ chế có thể có: 1) cơ chế tiêu tế bào trong đó tế bào gan nhiễm virus bị hủy diệt và được thay thế bằng các tế bào không bị nhiễm và 2) cơ chế không tiêu tế bào trong đó các cytokin kháng virus điều hòa giảm sự biểu hiện gene của HBV và đào thải HBV khỏi các tế bào gan mà không gây chết tế bào.Các tế bào gan có thời gian bán thải dài; vì vậy việc thải trừ cccDNA do sự luân chuyển của tế bào gan không phải là biện pháp thanh thải chính, ngoại trừ có thể trong thời gian luân chuyển tế bào nhanh, như trong thời gian nhiễm viêm gan cấp tính. Việc quan sát thấy cccDNA có thể tồn tại kéo dài ngay cả ở những bệnh nhân có chứng cứ huyết thanh học về thanh thải virus đã nêu bật vai trò quan trọng của đáp ứng miễn dịch trong việc kiểm soát sự sao chép của virus và đưa ra quan điểm về các cách tiếp cận tiềm năng không phải về mặt virus học đối với việc điều trị viêm gan B mạn tính.
Hình 2. Sự kiểm soát HBV do hệ thống miễn dịch.
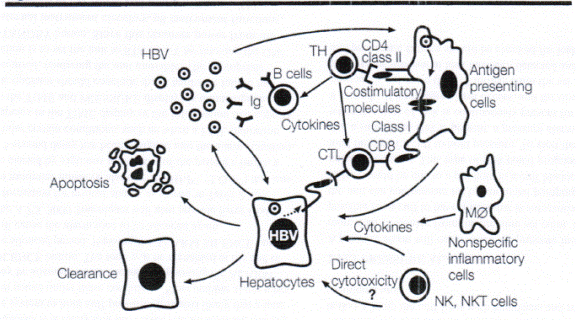
TH: tê bào T hỗ trợ
III. cccDNA là một đích điều trị
cccDNA của HBV là một đích điều trị hấp dẫn do vai trò then chốt của nó trong sự sao chép và sự tồn tại kéo dài của virus. Các chất tương tự nucleos(t)ide ức chế polymerase của virus nhưng không ức chế con đường tái sinh nội bào bổ sung cccDNA. Kết quả là sự sao chép virus thường quay trở lại các nồng độ trước khi điều trị sau khi ngừng sử dụng những chất này. Việc sử dụng nhiều kỹ thuật phân tử khác nhau, các nghiên cứu kiểm tra những thay đổi về cccDNA của bệnh nhân trong khi điều trị bằng chất tương tự nucleos(t)ide đơn độc hoặc phối hợp với peginterferon, đã cho thấy giảm 1,0-2,4 log10 bản sao (copies)/tế bào về các nồng độ cccDNA, nhưng không triệt tiêu, so với các dạng DNA sao chép của HBV khác ở gan. Dựa trên những dữ liệu này, các mô hình toán học dự đoán rằng sẽ phải mất lâu hơn 14 năm để làm sạch hoàn toàn cccDNA nội bào của một gan người nhiễm HBV mạn tính. Các ảnh hưởng lâm sàng của phát hiện này là ở chỗ phải dùng các chất tương tự nucleos(t)ide trong những khoảng thời gian cực dài, nếu không nói là vô thời hạn. Mục tiêu của việc “chữa khỏi” viêm gan B mạn tính với các thuốc dùng đường uống hiện có là không thể được vì không thể sử dụng các thuốc này một cách hiệu quả với thời gian dài như vậy, và chúng không có hiệu quả làm triệt tiêu cccDNA từ gan.
Gần đây, các cách tiếp cận mới khác đã được thăm dò đối với cccDNA đích. Trong một nghiên cứu, một tế bào T gây độc tế bào đã được biến đổi về mặt di truyền mang thụ thể tế bào-T chimera trực tiếp chống lại các protein bề mặt HBV trình diện trên các tế bào nhiễm HBV đã được phát triển và sử dụng để cung cấp tế bào T người sơ cấp có tính đặc hiệu như kháng thể. Khi được ủ cùng với các tế bào gan người sơ cấp bị nhiễm HBV, những tế bào T đặc hiệu kháng nguyên theo kỹ thuật di truyền này đã đào thải chọn lọc các tế bào bị nhiễm HBV và do đó là các tế bào đích có cccDNA. Tuy nhiên, việc tìm một hệ thống chuyển giao đối với phương thức điều trị này và rủi ro tiềm ẩn về tổn thương gan có thể làm hạn chế cách tiếp cận này. Một nghiên cứu khác in vitro đã sử dụng một RNA can thiệp nhỏ nhắm chống lại tín hiệu khu trú ở nhân trong protein lõi của HBV và đã quan sát thấy tác nhân này ức chế rõ rệt sự khuyếch đại cccDNA. Dựa trên kết quả này, những nghiên cứu thêm ở những mô hình động vật của nhóm tác nhân này đã được bảo đảm rõ ràng.
IV. Có phải cccDNA đóng vai trò trong dự đoán đáp ứng đối với trị liệu kháng virus?
cccDNA được cho có vai trò trong sự sao chép bền bĩ của virus nên việc định lượng cccDNA có thể có ích lợi về mặt lâm sàng. Các nghiên cứu đã cho thấy một sự tương quan giữa cccDNA và các nồng độ HBV DNA trong gan; tuy nhiên, không thực tế khi đo cccDNA ở các sinh thiết gan trong thực hành lâm sàng thường quy. Vì vậy, một chỉ điểm thay thế đối với các nồng độ cccDNA sẽ là một công cụ hữu ích để theo dõi hoạt tính của bệnh gan liên quan với HBV. cccDNA được cho là khuôn mẫu chính để phiên mã và dịch mã các kháng nguyên của virus, kể cả HBsAg, những thay đổi về nồng độ HBsAg trong huyết thanh có thể được sử dụng như một chỉ điểm thay thế đối với những thay đổi về các nồng độ cccDNA.
Một nghiên cứu đã khảo sát mối quan hệ tiềm năng này giữa các nồng độ HBsAg trong huyết thanh trước điều trị và nồng độ HBV DNA và cccDNA toàn phần ở những bệnh nhân đang điều trị với peginterferon và lamivudine đã phát hiện một sự tương quan giữa các nồng độ HBsAg trong huyết thanh và các nồng độ HBV DNA trong gan. Những bệnh nhân có nồng độ cccDNA, HBV DNA trong gan và nồng độ HBsAg, mà không phải nồng độ HBV DNA trong huyết thanh, thấp hơn mức cơ bản rất có thể phát triển sự ức chế kéo dài về mặt virus học. Đã quan sát thấy các kết quả tương tự ở những bệnh nhân được điều trị với peginterferon alfa và adefovir.Những nghiên cứu này cung cấp chứng cứ sơ bộ, có thể giải thích tại sao sự mất HBsAg tự phát hoặc do điều trị là một chỉ điểm huyết thanh mạnh nhất đối với sự ức chế kéo dài về mặt virus học, mặc dù các phát hiện này cần được xác nhận bởi những nghiên cứu khác bao gồm các số lượng bệnh nhân lớn hơn.
V.Tỷ lệ mất HbsAg như thế nào với những điều trị hiện tại?
Như đã được đề cập trước đây, mất HBsAg là chỉ điểm thay thế mạnh nhất về đáp ứng dài hạn đối với trị liệu kháng virus. Tỷ lệ mất HBsAg trong khi điều trị với các đơn trị liệu đã được chấp thuận, các thuốc kháng HBV trong thực nghiệm và các chế độ điều trị được trình bày ở Bảng 1. Hiếm khi đạt được mất HBsAg trong khi điều trị với các chất tương tự nucleos(t)ide (≤1,0% đến 3,2%). Đã đạt được các kết quả tốt hơn cận biên (3,0% đến 7,8%) với chế độ điều trị bằng interferon alfa. Sự kết hợp peginterferon alfa với lamivudine không đem lại lợi ích thêm nào về sự thanh thải HBsAg cao hơn việc dùng peginterferon alfa đơn độc. Những ảnh hưởng của trị liệu kháng virus trên các nồng độ cccDNA được trình bày ở Bảng 2.
Bảng 1. Tỷ lệ mất HBsAg ở thời điểm 1 năm với đơn trị liệu và chế độ điều trị phối hợp
Tỷ lệ mất HBsAg theo loại điều trị, % | Bệnh nhân HBsAg dương tính | Bệnh nhân HBsAg âm tính |
Không điều trị (Kiểm tra về mặt mô học) | 1,8 | <1,0 |
Adefovir | 0 | NA |
Entecavir | 2,0 | <1,0 |
| Lamivudine | <1,0 | <1,0 |
| Telbivudine | <1,0 | <1,0 |
| Tebofovir | 3,2 | NA |
| Interferon chuẩn | 7,8 | NA |
Peginterferon alfa-2a | 3,0 | 4,0 |
Peginterferon alfa-2a + Lamivudine | 3,0 | 3,0 |
NA: không đánh giá
VI.Ảnh hưởng của trị liệu kháng virus trên kết quả của bệnh gan và sự phát triển Ung thư biểu mô tế bào gan
Những cải thiện về bệnh gan và tỷ lệ tử vong liên quan với HBV đã được quan sát ở các bệnh nhân có thể duy trì sự ức chế HBV DNA dài hạn trong khi điều trị hoặc khi không có điều trị. Các dữ liệu trong thời gian dài (>5 năm) về các kết quả lâm sàng sau khi trị liệu kháng virus có sẵn đối với interferon alfa và lamivudine, trong khi các dữ liệu theo dõi ngắn hạn (4-5 năm) có sẵn đối với adefovir và entercavir.
Các nghiên cứu theo dõi dài hạn ở phương Tây trên những bệnh nhân có HBsAg dương tính được điều trị với interferon alfa đã cho thấy tỷ lệ sống còn của bệnh nhân được cải thiện và giảm tỷ lệ gan mất bù ở những bệnh nhân đã đạt được sự thanh thải HBeAg kéo dài. Ngược lại, các lợi ích lâm sàng dài hạn của liệu pháp interferon alfa ở những bệnh nhân châu Á có HBeAg dương tính không rõ và không có lợi ích dài hạn trong việc phòng ngừa ung thư biểu mô tế bào gan hoặc các biến chứng khác liên quan đến xơ gan đã được quan sát ở các bệnh nhân châu Á là những người có chuyển đổi huyết thanh HBsAg so với nhóm chứng sau thời gian theo dõi trung bình 9 năm. Mặc dù tỷ lệ thanh thải HBV DNA kéo dài với điều trị bằng interferon alfa thấp hơn ở những bệnh nhân có HBsAg âm tính so với những bệnh nhân có HbeAg dương tính, đã quan sát thấy giảm tỷ lệ tiến triển đến xơ gan và tử vong liên quan với gan. Cuối cùng, vai trò của interferon alfa trong việc phòng ngừa ung thư biểu mô tế bào gan là không chắc chắn.
Bảng 2. Thay đổi trung bình về các nồng độ cccDNA trong gan, HBV DNA trong gan và HBV DNA ở huyết thanh trong 48-52 tuần trị liệu kháng virus.
Tác giả | Chế độ điều trị thuốc | Số bệnh nhân, n | cccDNA, log10 copies/mL | Nồng độ HBV DNA toàn phần trong gan, log10 copies/mL | Nồng độ HBV DNA trong huyết thanh, log10 copies/mL |
Werle- Lapostolle và cộng sự | Adefovir 10 mg x 48 tuần | Adefovir: n=22 Giả dược: N=10 | -0,80 0,32 | -1,63 -0,0001 | -4,70 -0,60 |
| Wong và cộng sự | Lamivudine 100 mg Entecavir 0,5 mg x 48 tuần | Lamivudine n=19 Entecavir: n=20 | -0,98 -1,02 | -2,00 -1,88 | -4,75 -4,81 |
| Chan và cộng sự | Peginterferon alfa-2b 1,0-1,5 µg/kg /tuần x 32 tuần + Lamividine 100 mg x 96 tuần | Peginterferon/ Lamivudine: n=26 | -1,23 | -2,52 | -5,48 |
| Wursthorn và cộng sự | Peginterferon alfa-2b 1,5 µg/kg/tuần + Adefovir 10 mg x 48 tuần | Peginterferon/ Adefovir n=26 | -2,40 | -2,20 | -4,90 |
| Wong và cộng sự | Telbivudine 600 mg Lamivudine x 52 tuần | Telbivudine n=38 Lamivudine n=32 | -0,11 -0,07 | -1,2 -1,3 | -6,0 -4,1 |
Sử dụng liệu pháp chất tương tự nucleos(t)ide trong 1 năm hoặc lâu hơn có liên quan với những cải thiện về các thông số sinh hóa, virus học và mô học và không có sự đề kháng với trị liệu kháng virus. Đã quan sát thấy giảm viêm hoại tử và xơ hóa gan và ngay cả thoái triển xơ gan ở những bệnh nhân duy trì được sự ức chế virus bằng lamivudine trong hơn 3 năm. Ngược lại, các lợi ích về mô học mất đi ở những bệnh nhân đề kháng thuốc. Một thử nghiệm ngẫu nhiên có đối chứng với giả dược đã báo cáo là những bệnh nhân bị bệnh gan tiến triển được điều trị với lamivudine có tỷ lệ gan mất bù thấp hơn, giảm sự cần thiết phải ghép gan, giảm phát triển ung thư biểu mô tế bào gan và tỷ lệ tử vong liên quan với gan thấp hơn so với nhóm chứng.
Trong một nghiên cứu, điều trị dài hạn với adefovir trong 5 năm có liên quan với giảm xơ hóa ở những bệnh nhân duy trì sự đáp ứng về mặt virus học.[38] Tuy nhiên, 2% bệnh nhân đã phát triển ung thư biểu mô tế bào gan, chỉ ra rằng việc điều trị kháng virus dài hạn không phòng ngừa hoàn toàn biến chứng này.
Các nghiên cứu ngắn hạn điều trị với entecavir, telbivudine và tenofovir đã báo cáo tỷ lệ ức chế virus cao hơn so với lamivudine và adefovir. Với hiệu lực trội hơn và độ bền cao hơn của entecavir và telbivudine, người ta dự đoán các kết quả tương tự hoặc ngay cả trội hơn khi sử dụng kéo dài. Tuy nhiên, dữ liệu dài hạn về ảnh hưởng của những thuốc này trên sự phát triển ung thư biểu mô tế bào gan vẫn còn phải được chứng minh.
VII.Chứng cứ về việc không chữa khỏi bệnh: Tái hoạt động với sự chuyển đổi huyết thanh từ dương tính với kháng thể kháng HBs và kháng thể kháng HBc thành dương tính với HBsAg
Sự tái hoạt động của HBV ít được xác định trong các nghiên cứu lâm sàng. Thuật ngữ “tái hoạt động” được sử dụng hoán đổi lẫn nhau trong y văn để nói đến sự tăng HBV DNA trong huyết thanh và/hoặc tăng các nồng độ alanine aminotransferase (ALT) trong huyết thanh và/hoặc tái xuất hiện HbsAg trong huyết thanh (Bảng 3). Trường hợp thứ hai này được gọi hay hơn là chuyển đổi huyết thanh HBsAg, có thể xảy ra có hoặc không có viêm gan, mặc dù chuyển đổi huyết thanh HBsAg hầu như luôn được kèm theo bởi sự tăng các nồng độ HBV DNA và “viêm gan”. Trong điều trị gây độc tế bào, việc xác định sự tái hoạt động của HBV được đề nghị sử dụng trong một vài nghiên cứu là sự tăng nồng độ HBV DNA > 1 log10 khi so với mức cơ bản hoặc một sự tăng tuyệt đối vượt quá 1.000 x 106 genome equivalent/mL cùng với “viêm gan” được định nghĩa là tăng ALT huyết thanh gấp 3 lần vượt quá phạm vi tham chiếu hoặc tăng tuyệt đối ALT huyết thanh > 100 IU/L.
Bảng 3. Định nghĩa sự tái hoạt động của HBV trong khi điều trị gây độc tế bào
Bối cảnh lâm sàng | Định nghĩa |
HBsAg dương tính | Tăng nồng độ HBV DNA trong huyết thanh > 1 log10 IU/mL so với mức cơ bản hoặc tăng tuyệt đối HBV DNA > 104-5 IU/mL được kèm theo bởi tăng nồng độ ALT huyết thanh gấp 3 lần vượt quá phạm vi tham chiếu hoặc tăng tuyệt đối ALT huyết thanh > 100 IU/L |
HBsAg âm tính | Chuyển đổi huyết thanh HBsAg (tái xuất hiện HBsAg trong huyết thanh ± mất kháng thể kháng HBs), được kèm theo bởi tăng nồng độ HBV DNA trong huyết thanh > 1 log10 IU/mL so với mức cơ bản hoặc tăng tuyệt đối HBV DNA > 104-5 IU/mL và tăng nồng độ ALT huyết thanh gấp 3 lần vượt quá phạm vi tham chiếu hoặc tăng tuyệt đối ALT huyết thanh > 100 IU/L |
Sự chuyển đổi huyết thanh HBsAg đã được mô tả sau khi dùng hóa liệu pháp, sử dụng steroid liều cao và ghép tủy xương hoặc tế bào gốc tạo máu. Ngoài ra, nhiễm HBV mới (de novo) sau ghép gan đã được báo cáo ở những người có HBsAg âm tính đã nhận gan từ người hiến tặng dương tính với kháng thể kháng HBc. Những quan sát lâm sàng này đã cung cấp chứng cứ thuyết phục nhất là HBV có thể tồn tại kéo dài sau khi đã khỏi về mặt huyết thanh và việc kiểm soát dài hạn sự sao chép của HBV phụ thuộc vào đáp ứng miễn dịch hoàn toàn, có lẽ được duy trì do sự mồi liên tục từ số virus còn lại.
Tỷ lệ tái hoạt động trong khi dùng hóa liệu pháp thấp hơn ở những bệnh nhân có HBsAg âm tính (đã khỏi về mặt huyết thanh học) so với những bệnh nhân có HBsAg dương tính (người mang virus dạng bất hoạt). Khó xác định chính xác tỷ lệ chuyển đổi huyết thanh do một số yếu tố: cỡ mẫu nhỏ, độ nhạy của xét nghiệm được sử dụng, thời gian theo dõi khác nhau, chế độ điều trị hóa liệu pháp khác nhau và các nhóm nghiên cứu khác nhau. Dựa trên hàng loạt ca bệnh, tỷ lệ chuyển đổi huyết thanh thay đổi từ 14% đến 30% ở những bệnh nhân dùng hóa liệu pháp, 11% đến 50% ở những bệnh nhân được ghép tủy xương hoặc tế bào gốc, và 50% đến 78% ở những bệnh nhân có HBsAg âm tính được ghép gan có kháng thể kháng HBc dương tính.
Sự chuyển đổi huyết thanh và tái hoạt động của HBsAg rất có thể là do nồng độ thấp kéo dài của cccDNA trong tế bào gan với sự tăng sao chép của HBV gây ra do ức chế miễn dịch.Chuyển đổi huyết thanh và tái hoạt động thường xảy ra muộn hơn (6-52 tháng; trung bình: 19 tháng) so với sự tái hoạt động ở bệnh nhân có HBsAg dương tính. Trong trường hợp ghép tủy xương hoặc tế bào gốc cùng loài dị gen, việc không có sự miễn dịch ở người hiến tặng cũng có thể đóng vai trò trong chuyển đổi huyết thanh HBsAg. Tái phát viêm gan trên lâm sàng có thể qua trung gian của độc tính tế bào do các nồng độ HBV DNA nội bào rất cao hoặc do mất kiểm soát sự sao chép của HBV qua trung gian miễn dịch với sự thanh thải nhanh các tế bào gan bị nhiễm virus dựa trên sự thiết lập đáp ứng miễn dịch.
Sự chuyển đổi huyết thanh và tái hoạt động của HBsAg rất có thể là do nồng độ thấp kéo dài của cccDNA trong tế bào gan với sự tăng sao chép của HBV gây ra do ức chế miễn dịch.Chuyển đổi huyết thanh và tái hoạt động thường xảy ra muộn hơn (6-52 tháng; trung bình: 19 tháng) so với sự tái hoạt động ở bệnh nhân có HBsAg dương tính. Trong trường hợp ghép tủy xương hoặc tế bào gốc cùng loài dị gen, việc không có sự miễn dịch ở người hiến tặng cũng có thể đóng vai trò trong chuyển đổi huyết thanh HBsAg. Tái phát viêm gan trên lâm sàng có thể qua trung gian của độc tính tế bào do các nồng độ HBV DNA nội bào rất cao hoặc do mất kiểm soát sự sao chép của HBV qua trung gian miễn dịch với sự thanh thải nhanh các tế bào gan bị nhiễm virus dựa trên sự thiết lập đáp ứng miễn dịch.
VIII.Bệnh nhân nào có nguy cơ về chuyển đổi huyết thanh HBsAg?
Chuyển đổi huyết thanh HBsAg có thể xảy ra hoặc trong hoặc sau thời gian ức chế miễn dịch. Khó nhận dạng các yếu tố nguy cơ đối với chuyển đổi huyết thanh vì chỉ có những số lượng nhỏ bệnh nhân được bao gồm trong các báo cáo đã công bố. Một số yếu tố nguy cơ đã được nhận dạng là sử dụng corticosteroid liều cao, sử dụng các chế độ điều trị chứa rituximab và corticosteroid, thiếu kháng thể kháng HBs ở người hiến tặng gan, và sự phát triển bệnh mảnh ghép chống lại vật chủ. Nói chung, nguy cơ của chuyển đổi huyết thanh HBsAg liên quan với mức độ và thời gian ức chế miễn dịch, và nồng độ HBV DNA có thể phát hiện được trước khi ức chế miễn dịch. Vì vậy, nguy cơ của chuyển đổi huyết thanh HBsAg cao hơn ở các bệnh nhân đang được ghép tủy xương hoặc tế bào gốc tạo máu hoặc ở những bệnh nhân đang điều trị bằng các kháng thể đơn dòng đặc hiệu trực tiếp chống lại tế bào B và tế bào T, như rituximab và alemtuzumab. Độ nặng của viêm gan sau sự chuyển đổi huyết thanh HBsAg chịu ảnh hưởng bởi giai đoạn của bệnh gan. Những bệnh nhân bị xơ gan có nguy cơ cao hơn về sự mất bù và suy gan sau chuyển đổi huyết thanh HBsAg với sự tái hoạt động trên lâm sàng. Nồng độ cccDNA cao so với mức cơ bản ở những bệnh nhân có HBsAg dương tính đã cho thấy là yếu tố dự đoán về chuyển đổi huyết thanh HBsAg trong thời gian dùng hóa liệu pháp. Tuy nhiên, định lượng cccDNA không phải là một chiến lược thực tiễn để đánh giá nguy cơ trong trường hợp điều trị lâm sàng nói chung. Các yếu tố dự đoán chuyển đổi huyết thanh đã được nhận dạng trong những nghiên cứu không đối chứng bao gồm giảm nồng độ kháng thể kháng HBs và tăng HBV DNA trong huyết thanh gấp 100 lần.
IX.Biểu hiện lâm sàng và quản lý sự chuyển đổi huyết thanh HBV HBsAg kèm tái hoạt động trên lâm sàng
Biểu hiện của sự chuyển đổi huyết thanh HBsAg và tái hoạt động trên lâm sàng có thể ở mức từ không có triệu chứng, tăng nhẹ nồng độ ALT trong huyết thanh đến mất bù gan rõ rệt và viêm gan tối cấp. Tỷ lệ tử vong ở bệnh nhân viêm gan tối cấp cao, trong khoảng từ 5% đến 40%, ngay cả khi có thiết lập trị liệu kháng virus. Viêm gan liên quan với chuyển đổi huyết thanh thường dẫn đến rối loạn chức năng gan nặng và cũng liên quan độc lập với nguy cơ cao hơn về phát triển suy gan tối cấp.
Quản lý trường hợp viêm gan đã được xác định bao gồm điều trị hỗ trợ tích cực và ngừng hóa liệu pháp tức thì, thiết lập trị liệu kháng virus sớm với các thuốc mạnh nhất có sẵn. Mục tiêu là cần phải ức chế nồng độ HBV DNA càng nhanh càng tốt. Một khi viêm gan đã phát triển trên lâm sàng, sẽ có tỷ lệ tử vong cao mặc dù đã bắt đầu trị liệu kháng virus. Điều này nhấn mạnh sự cần thiết theo dõi bệnh nhân chặt chẽ bằng cách theo dõi các nồng độ HBV DNA, sử dụng một xét nghiệm nhạy và can thiệp trước khi phát triển viêm gan trên lâm sàng. Một cách tiếp cận được đề nghị là theo dõi nồng độ HBV DNA mỗi 2-4 tuần trong 3 tháng đầu sau khi ngừng hóa liệu pháp và mỗi 3 tháng sau đó. Trong một nghiên cứu, sự tăng nồng độ HBV DNA trong huyết thanh gấp 100 lần đã xảy ra trước sự chuyển đổi huyết thanh và viêm gan trên lâm sàng ở tất cả bệnh nhân. Cách tiếp cận này cần được đánh giá trong các thử nghiệm theo thời gian khác.
X.Có thể phòng ngừa sự chuyển đổi huyết thanh HBsAg và sự tái hoạt động được không?
Vì HBV DNA trong huyết thanh tăng lên trước khi các nồng độ ALT trong huyết thanh tăng, trị liệu kháng virus được khởi đầu trước khi bắt đầu hóa liệu pháp hoặc ghép sẽ làm giảm hoặc phòng ngừa viêm gan trên lâm sàng. Thật vậy, điều này đã được chứng minh ở người mang HBsAg ở dạng bất hoạt. Trong một thử nghiệm ngẫu nhiên có đối chứng, 30 bệnh nhân u lymphô đang dùng hóa liệu pháp có hoặc không có ghép tế bào gốc tạo huyết đã được chọn ngẫu nhiên để cho dùng khởi đầu bằng lamivudine tức thì dưới dạng điều trị dự phòng hoặc lamivudine sử dụng chậm - dựa trên chứng cứ lâm sàng về sự tái hoạt động của HBV (như đã xác định trước đây). So sánh với lamivudine sử dụng chậm, lamivudine điều trị dự phòng làm giảm tỷ lệ tái hoạt động của HBV có ý nghĩa thống kê (0% so với 53% tương ứng) và cải thiện tỷ lệ sống còn không bị viêm gan so với lamivudine sử dụng chậm. Dựa vào điều này, một nghiên cứu ngẫu nhiên khác, và một số báo cáo ca bệnh,các bác sĩ lâm sàng nên bắt đầu trị liệu kháng virus trước khi thiết lập hóa trị liệu 1 tháng và tiếp tục trị liệu kháng virus trong 6 tháng sau khi phục hồi hệ thống miễn dịch ở những bệnh nhân có nồng độ HBV DNA < 2000 IU/mL và vô thời hạn cho đến khi đạt được kết quả điều trị đối với những bệnh nhân có nồng độ HBV DNA > 2000 IU/mL
Tỷ lệ chuyển đổi huyết thanh và tái hoạt động của virus ở những bệnh nhân HBsAg âm tính đang dùng hóa liệu pháp hoặc đang được ghép tủy xương thấp hơn (3,3%) so với những bệnh nhân HBsAg dương tính (26,0%), nhưng chưa đủ dữ liệu để khuyến cáo dự phòng thường quy. Tuy nhiên, nếu không dùng dự phòng, điều quan trọng là theo dõi sát bệnh nhân có nồng độ HBV DNA hàng loạt và xác định HBsAg để phát hiện sự tái hoạt động và chuyển đổi huyết thanh. Vấn đề cần được giải quyết là có phải việc dự phòng thường quy ít nhiều có hiệu quả chi phí so với theo dõi tích cực. Cho đến khi có những dữ liệu này, cách tiếp cận cá nhân được khuyến cáo. Ngược lại, do tỷ lệ cao về chuyển đổi huyết thanh HBsAg sau khi ghép gan sử dụng gan của người hiến tặng có kháng thể kháng HBc dương tính ở người nhận có huyết thanh âm tính, nên điều trị dự phòng. Các chiến lược đã được sử dụng với sự thành công khác nhau bao gồm globulin miễn dịch kháng viêm gan B đơn độc, lamivudine đơn độc, hoặc phối hợp 2 loại này. Không khuyến cáo mạnh mẽ vì không có những thử nghiệm có đối chứng.
Tỷ lệ chuyển đổi huyết thanh và tái hoạt động của virus ở những bệnh nhân HBsAg âm tính đang dùng hóa liệu pháp hoặc đang được ghép tủy xương thấp hơn (3,3%) so với những bệnh nhân HBsAg dương tính (26,0%), nhưng chưa đủ dữ liệu để khuyến cáo dự phòng thường quy. Tuy nhiên, nếu không dùng dự phòng, điều quan trọng là theo dõi sát bệnh nhân có nồng độ HBV DNA hàng loạt và xác định HBsAg để phát hiện sự tái hoạt động và chuyển đổi huyết thanh. Vấn đề cần được giải quyết là có phải việc dự phòng thường quy ít nhiều có hiệu quả chi phí so với theo dõi tích cực. Cho đến khi có những dữ liệu này, cách tiếp cận cá nhân được khuyến cáo. Ngược lại, do tỷ lệ cao về chuyển đổi huyết thanh HBsAg sau khi ghép gan sử dụng gan của người hiến tặng có kháng thể kháng HBc dương tính ở người nhận có huyết thanh âm tính, nên điều trị dự phòng. Các chiến lược đã được sử dụng với sự thành công khác nhau bao gồm globulin miễn dịch kháng viêm gan B đơn độc, lamivudine đơn độc, hoặc phối hợp 2 loại này. Không khuyến cáo mạnh mẽ vì không có những thử nghiệm có đối chứng.
Một cách tiếp cận được đề nghị để quản lý những người HBsAg dương tính và HBsAg âm tính đang dùng hóa liệu pháp hoặc ghép tủy xương hoặc tế bào gốc được cho thấy ở Hình 3. Có thể dùng lamivudine hoặc telbivudine để dự phòng ở những người HBsAg dương tính nếu thời gian điều trị dự phòng ngắn (<12 tháng) Adefovir hoặc entecavir được ưa chuộng hơn nếu dự đoán thời gian điều trị dài hơn. Cần theo dõi sát bệnh nhân trong khi đang trị liệu kháng virus và sau khi ngừng điều trị để bảo đảm không xảy ra sự tái hoạt động. Điều quan trọng tương đương là theo dõi sát những bệnh nhân không điều trị bằng cách thu thập các kết quả đo HBV DNA hàng loạt trong 12 tháng đầu sau khi hoàn tất hóa liệu pháp. Số lần theo dõi có thể giảm đi sau thời gian này nhưng nên tiếp tục vô thời hạn, vì đã có báo cáo về chuyển đổi huyết thanh HBsAg quá 3 năm sau khi ghép tủy xương. Nên bắt đầu trị liệu kháng virus nếu nồng độ HBV DNA tăng lên.
Hình 3. Cách tiếp cận được đề nghị để quản lý những người nhiễm HBV được điều trị ức chế miễn dịch nhằm phòng ngừa HBV tái hoạt động.
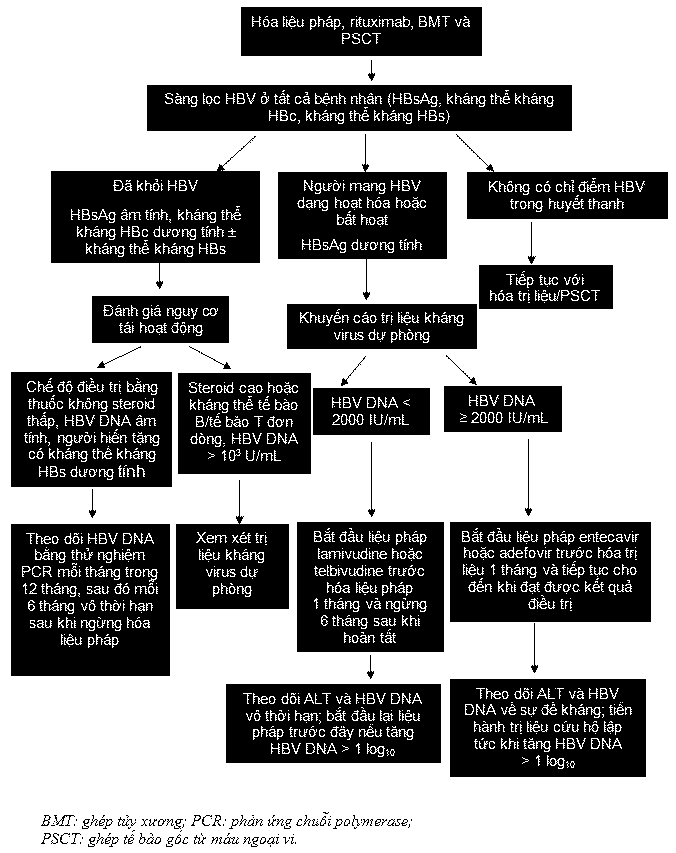
Tóm tắt: Các ảnh hưởng đối với thực hành lâm sàng
■ Virus viêm gan B là một virus DNA chuỗi kép không hoàn chỉnh sao chép qua trung gian RNA. Sự sao chéo xảy ra trong nucleocapsid của virus ở bào tương của tế bào gan.
■ Một đáp ứng đa clon, độc tế bào đa đặc hiệu và tế bào T hỗ trợ mạnh là cần thiết để kiểm soát sự sao chép của virus viêm gan B (HBV).
■ cccDNA đại diện cho một thể bổ sung của HBV DNA ổn định, cư trú ở nhân của tế bào gan. Nó là một khuôn mẫu để phiên mã tất cả mRNA của virus.
■ Các nồng độ cccDNA được duy trì bằng đường tái sinh bên trong tế bào từ các nucleocapsid của virus mới sinh. Sự đào thải cccDNA chủ yếu xảy ra thông qua các cơ chế tiêu tế bào và không tiêu tế bào được tạo ra do hệ thống miễn dịch.
■ Các nồng độ cccDNA có thể giảm xuống trong khi trị liệu kháng virus nhưng thường kéo dài sau khi hết nhiễm HBV về mặt huyết thanh học. Điều này giải thích cho hiện tượng hồi ứng virus được quan sát thấy khi ngừng các thuốc kháng virus. Vì vậy, những bệnh nhân tự khỏi bệnh hoặc do điều trị cần được theo dõi suốt đời về sự chuyển đổi huyết thanh HBsAg. Số lần theo dõi là mỗi 6-12 tháng.
■ Mất HBsAg là kết quả mạnh nhất của trị liệu nucleos(t)ide nhưng chỉ đạt < 3% bệnh nhân được điều trị. Tỷ lệ mất HBsAg cao hơn với trị liệu interferon/peginterferon (3% đến 8%) nhưng về tổng thể vẫn còn kém.
■ Điều trị dài hạn bằng các chất tương tự nucleos(t)ide có liên quan với giảm sự tiến triển của bệnh gan, cải thiện tỷ lệ sống còn và giảm tỷ lệ ung thư biểu mô tế bào gan. Sự phát triển đề kháng thuốc có liên quan với mất lợi ích về lâm sàng.
■ Sự chuyển đổi huyết thanh HBsAg đã được mô tả sau khi điều trị ức chế miễn dịch bằng steroid liều cao, hóa trị liệu ung thư, ghép tế bào gan và tế bào gốc đối với các khối u ác tính cơ quan tạo máu và tạng đặc cũng như sau khi ghép gan đúng vị trí ở những người HBsAg âm tính nhận gan từ những người hiến tặng có kháng thể kháng HBc dương tính.
■ Những bệnh nhân đang dùng hóa liệu pháp gồm các thuốc ức chế miễn dịch mạnh cần phải được sàng lọc HBsAg. Những người dương tính cần điều trị dự phòng kháng HBV để chống lại sự chuyển đổi huyết thanh HBsAg.
■ Chưa có đủ chứng cứ để khuyến cáo điều trị dự phòng kháng HBV ở bệnh nhân HBsAg âm tính. Nên xem xét điều trị dự phòng những bệnh nhân có nguy cơ cao về chuyển đổi huyết thanh HBsAg (tức là những người đang dùng chế độ điều trị thuốc chứa steroid hoặc kháng thể đơn dòng chống lại tế bào B hoặc T, những người có HBV DNA có thể phát hiện được, hoặc người bị xơ gan sẵn từ trước).
■ Những bệnh nhân không điều trị dự phòng kháng HBV cần được theo dõi vô thời hạn.
NGUỒN DRTHUTHUY
Không có nhận xét nào:
Đăng nhận xét